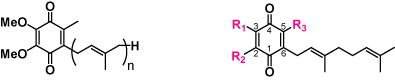 |
  |
  |
  |
  |
  |
 | 化合物ギャラリー | ||
|
当グループでこれまでに合成した化合物の中から、代表的なものを紹介します。 下の一覧から興味のある化合物名をクリックして下さい。 |
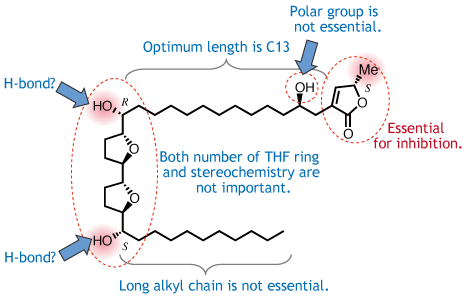
 | アセトゲニン |  | Δlac-アセトゲニン |
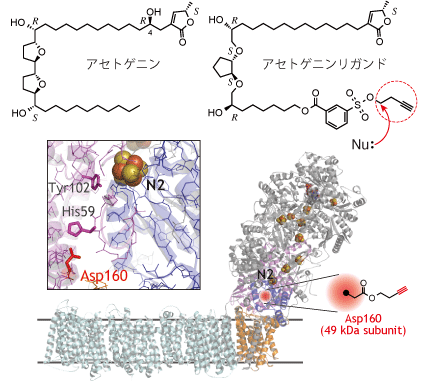
 | アセトゲニンリガンド |

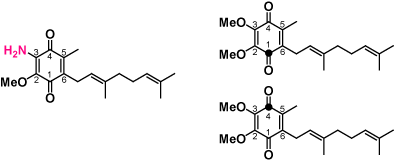
 | 天然・合成ユビキノン |  | ロドキノンと13Cユビキノン |
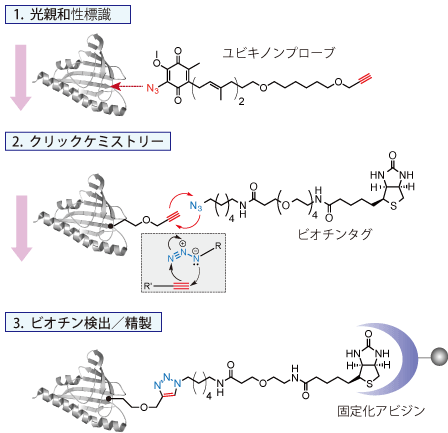
 | ハイブリッドキノン |  | ユビキノンプローブ |

 | フルアジナム |  | MP-24 |
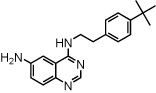
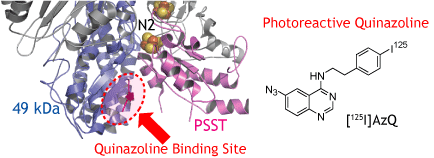
 | Cap-24 |  | キナゾリン |

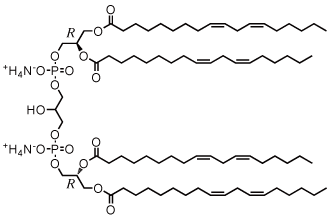
 | カルジオリピン |
 |  |
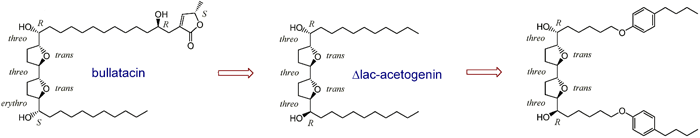 | |
| 天然アセトゲニンの構造展開の過程で、天然物に共通構造ユニットとして広く認められるγ-ラクトン環を持たない化合物(Δlac-アセトゲニン)を合成した。Δlac-アセトゲニンは、ブラタシンと同等の活性を保持し、しかも天然型アセトゲニンとは全く異なる作用機構を示す新規な阻害剤であることを明らかにした。 | |
 | |
 |  |
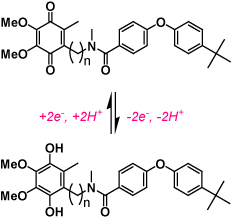 | |
| ユビキノン環とカプサイシンをハイブリッドし、ミトコンドリア呼吸鎖において基質あるいは阻害剤にもなる『ハイブリッドキノン』を合成した。ウシ心筋ミトコンドリア複合体-IIと複合体-IIIでは呼吸基質として、複合体-Iでは強力な阻害剤として機能する。 | |
 | |
 |  |
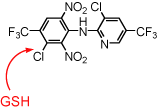 | |
| フルアジナムは石原産業(株)によって開発された殺菌剤である。この化合物は、ミトコンドリアのマトリックス内に存在する還元型グルタチオンと速やかに反応(求核置換)し、瞬時に失活するというユニークな脱共役剤(アンカップラー)である。これにより、エネルギー変換生体膜の脱共役状態の持続時間を自由に制御することが可能となった。フルアジナムは、選択性に優れた殺菌剤として広く利用されている。 | |
 | |